Bewehrungskorrosion: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| (21 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
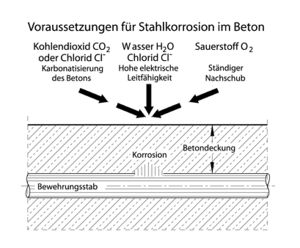
[[Datei:Korrosion.jpg|mini|gerahmt|Voraussetzungen für Stahlkorrosion im Beton]] | [[Datei:Korrosion.jpg|mini|gerahmt|Voraussetzungen für Stahlkorrosion im Beton]] | ||
[[Datei:AnodeKathode.jpg|mini|Bildung von anodischen und kathodischen Bereichen bei der Korrosion von Metallen<br><small>Quelle: Raupach, M.; Orlowsky, J.: Schutz und Instandsetzung von Betontragwerken.</small>]] | |||
Eisen und [[Stahl]] bilden unter Einwirkung von Wasser und Sauerstoff (Sauerstoffkorrosion) - verbunden mit einer Volumenvergrößerung - das leicht abblätternde und poröse [[Eisenoxid]] (genau genommen eine Kombination aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser), allgemein als Rost bezeichnet. <br /> | |||
Bei Stahlbeton spielt die [[Korrosion]] der [[Bewehrung]] und der Schutz, den der Beton der Bewehrung bietet, eine wichtige Rolle ([[passiver Korrosionsschutz]]).<br /> | |||
Beginnt die Bewehrung zu korrodieren, kann die damit verbundene Vergrößerung des Volumens zum [[Abplatzen]] des Betons über der korrodierenden Bewehrung führen. Bei fortschreitender Korrosion kann der Substanzverlust an der Bewehrung die [[Tragfähigkeit]] der Konstruktion gefährden.<br /> | |||
''Korrosionsvorgänge''<br /> | |||
Das als stabiles Oxid gewonnene Eisenerz (Fe<sub><small>2</small></sub>O<sub><small>3</small></sub>) wird bei der Herstellung von Eisen und Stahl durch Energiezufuhr auf ein höheres Energieniveau (Fe) angehoben, ist aber auf diesem Energieniveau thermodynamisch nicht stabil und hat das Bestreben, in den energieärmeren Zustand als Oxid zurückzukehren. Diese Korrosion bzw. Oxidation von Metallen ist ein elektrochemischer Vorgang, der immer an das Vorhandensein eines [[Elektrolyt|Elektrolyten]], meist eine wässrige Lösung, für den Transport von Ionen gebunden ist. Im Kontakt mit dem Elektrolyten gehen an der [[Anode]] eines korrodierenden Stahls positiv geladene Metallionen (Me<sup>+</sup>) in Lösung, die überschüssigen Elektronen (e<sup>–</sup>) wandern zur [[Kathode]] und reagieren dort mit Wasser und im Wasser gelösten Sauerstoff zu negativ geladenen Hydroxylionen (OH<sup>–</sup>). Vereinfacht betrachtet entspricht diese Korrosion den Vorgängen in einer Batterie mit einem elektrischen und einem elektrolytischen Teil eines Stromkreislaufs, wobei anodische Bereiche und kathodische Bereiche benachbart in einem Stahlwerkstück vorhanden sein können. <br /> | |||
Je höher das elektrochemische Potential eines Metalls in wässrigen Lösungen ist, desto geringer ist die Korrosionsbereitschaft des Metalls oder desto edler ist das Metall. Als Edelmetall werden Metalle bezeichnet, die unter normalen atmosphärischen Bedingungen nicht korrodieren.<br /> | |||
Die [[Bewehrung]] im [[Stahlbeton]] ist durch die hohe Alkalität des Porenwassers mit [[pH-Wert|pH-Werten]] zwischen 12,5 und 13,5 vor Korrosion geschützt, da sich bei solchen pH-Werten auf der Stahloberfläche eine Passivschicht bildet ([[Passiver Korrosionsschutz]]), welche die anodische Eisenauflösung praktisch unterbindet. Der passive Korrosionsschutz kann durch [[Carbonatisierung]] oder [[Chloridgehalt|Chlorideinwirkung]] verloren gehen.<br /> | |||
''Instandsetzungsprinzipien''<br /> | |||
Maßnahmen zur Herstellung des Korrosionsschutzes im Rahmen von Instandsetzungs- bzw. Instandhaltungsmaßnahmen beruhen auf diesen elektrochemischen Gesetzmäßigkeiten:<br /> | |||
a) Unterbinden des anodischen Teilprozesses<br /> | |||
Eine Möglichkeit besteht darin, das alkalische Milieu und damit den [[Passiver Korrosionsschutz|passiven Korrosionsschutz]] in der Umgebung der [[Bewehrung]] durch Auftrag eines zementgebundenen Mörtels wiederherzustellen (Repassivierung bzw. Realkalisierung). <br /> | |||
Eine zweite Möglichkeit ist, die Bewehrung zu zwingen, nur kathodisch zu wirken (kathodischer Korrosionsschutz). Hierbei werden geringe Fremdströme über eine Anode (teilweise Opferandoden aus unedlen Metallen) auf der Stahlbetonoberfläche aufgebracht. Die Bewehrung ist die Kathode. Der so bewirkte Elektronenüberschuss in der Bewehrung behindert die anodische Eisenauflösung durch Verschiebung des Reaktionsgleichgewichts in Richtung der kathodischen Teilreaktion (Sauerstoffreduktion). Durch elektrochemische Reaktionen entstehende Hydroxidionen erhöhen den pH-Wert in der Kontaktzone zwischen Bewehrung und Beton, so dass wieder ein [[passiver Korrosionsschutz]] entsteht. Chloridionen wandern langfristig von der Kathode (Bewehrung) zur Anode (Betonoberfläche).<br /> | |||
Eine weitere Möglichkeit bietet die Trennung des Elektrolyten vom Stahl durch eine wirksame [[Beschichtung]] der Bewehrung.<br /> | |||
b) Unterbinden des elektrolytischen Teilprozesses<br /> | |||
Durch Absenkung des Wassergehalts im Beton kann die Korrosionsgeschwindigkeit auf praktisch vernachlässigbare Werte gesenkt werden, da alle beschriebenen Transportvorgänge im Beton gehemmt werden. Dazu wird über geeignete Oberflächenschutzsysteme das Eindringen von Wasser von außen verhindert. Darüber hinaus muss aber auch verhindert werden, dass Wasserdampf von innen oder Bodenfeuchte in das Bauteil eindringen. | |||
==Literatur== | |||
*[https://fwbau.verlagbt.de/eintrag/3-475-2008-.html Raupach, Michael; Orlowsky, Jeanette: Schutz und Instandsetzung von Betontragwerken. Verlag Bau+Technik GmbH, Düsseldorf 2008] | |||
*[http://fwbau.verlagbt2.de.w014576d.kasserver.com/eintrag/2-9-1995-640.html Gräf, Herbert; Thielen, Gerd: Betontechnologische Einflüsse auf Beginn und Fortschritt von Stahlkorrosion im Beton. In beton 9-1995, S. 640] | |||
[[Category:Bewehrung]] | |||
Aktuelle Version vom 3. Januar 2019, 15:24 Uhr
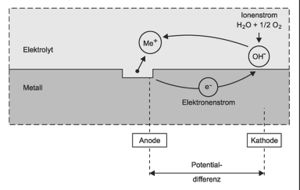
Quelle: Raupach, M.; Orlowsky, J.: Schutz und Instandsetzung von Betontragwerken.
Eisen und Stahl bilden unter Einwirkung von Wasser und Sauerstoff (Sauerstoffkorrosion) - verbunden mit einer Volumenvergrößerung - das leicht abblätternde und poröse Eisenoxid (genau genommen eine Kombination aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser), allgemein als Rost bezeichnet.
Bei Stahlbeton spielt die Korrosion der Bewehrung und der Schutz, den der Beton der Bewehrung bietet, eine wichtige Rolle (passiver Korrosionsschutz).
Beginnt die Bewehrung zu korrodieren, kann die damit verbundene Vergrößerung des Volumens zum Abplatzen des Betons über der korrodierenden Bewehrung führen. Bei fortschreitender Korrosion kann der Substanzverlust an der Bewehrung die Tragfähigkeit der Konstruktion gefährden.
Korrosionsvorgänge
Das als stabiles Oxid gewonnene Eisenerz (Fe2O3) wird bei der Herstellung von Eisen und Stahl durch Energiezufuhr auf ein höheres Energieniveau (Fe) angehoben, ist aber auf diesem Energieniveau thermodynamisch nicht stabil und hat das Bestreben, in den energieärmeren Zustand als Oxid zurückzukehren. Diese Korrosion bzw. Oxidation von Metallen ist ein elektrochemischer Vorgang, der immer an das Vorhandensein eines Elektrolyten, meist eine wässrige Lösung, für den Transport von Ionen gebunden ist. Im Kontakt mit dem Elektrolyten gehen an der Anode eines korrodierenden Stahls positiv geladene Metallionen (Me+) in Lösung, die überschüssigen Elektronen (e–) wandern zur Kathode und reagieren dort mit Wasser und im Wasser gelösten Sauerstoff zu negativ geladenen Hydroxylionen (OH–). Vereinfacht betrachtet entspricht diese Korrosion den Vorgängen in einer Batterie mit einem elektrischen und einem elektrolytischen Teil eines Stromkreislaufs, wobei anodische Bereiche und kathodische Bereiche benachbart in einem Stahlwerkstück vorhanden sein können.
Je höher das elektrochemische Potential eines Metalls in wässrigen Lösungen ist, desto geringer ist die Korrosionsbereitschaft des Metalls oder desto edler ist das Metall. Als Edelmetall werden Metalle bezeichnet, die unter normalen atmosphärischen Bedingungen nicht korrodieren.
Die Bewehrung im Stahlbeton ist durch die hohe Alkalität des Porenwassers mit pH-Werten zwischen 12,5 und 13,5 vor Korrosion geschützt, da sich bei solchen pH-Werten auf der Stahloberfläche eine Passivschicht bildet (Passiver Korrosionsschutz), welche die anodische Eisenauflösung praktisch unterbindet. Der passive Korrosionsschutz kann durch Carbonatisierung oder Chlorideinwirkung verloren gehen.
Instandsetzungsprinzipien
Maßnahmen zur Herstellung des Korrosionsschutzes im Rahmen von Instandsetzungs- bzw. Instandhaltungsmaßnahmen beruhen auf diesen elektrochemischen Gesetzmäßigkeiten:
a) Unterbinden des anodischen Teilprozesses
Eine Möglichkeit besteht darin, das alkalische Milieu und damit den passiven Korrosionsschutz in der Umgebung der Bewehrung durch Auftrag eines zementgebundenen Mörtels wiederherzustellen (Repassivierung bzw. Realkalisierung).
Eine zweite Möglichkeit ist, die Bewehrung zu zwingen, nur kathodisch zu wirken (kathodischer Korrosionsschutz). Hierbei werden geringe Fremdströme über eine Anode (teilweise Opferandoden aus unedlen Metallen) auf der Stahlbetonoberfläche aufgebracht. Die Bewehrung ist die Kathode. Der so bewirkte Elektronenüberschuss in der Bewehrung behindert die anodische Eisenauflösung durch Verschiebung des Reaktionsgleichgewichts in Richtung der kathodischen Teilreaktion (Sauerstoffreduktion). Durch elektrochemische Reaktionen entstehende Hydroxidionen erhöhen den pH-Wert in der Kontaktzone zwischen Bewehrung und Beton, so dass wieder ein passiver Korrosionsschutz entsteht. Chloridionen wandern langfristig von der Kathode (Bewehrung) zur Anode (Betonoberfläche).
Eine weitere Möglichkeit bietet die Trennung des Elektrolyten vom Stahl durch eine wirksame Beschichtung der Bewehrung.
b) Unterbinden des elektrolytischen Teilprozesses
Durch Absenkung des Wassergehalts im Beton kann die Korrosionsgeschwindigkeit auf praktisch vernachlässigbare Werte gesenkt werden, da alle beschriebenen Transportvorgänge im Beton gehemmt werden. Dazu wird über geeignete Oberflächenschutzsysteme das Eindringen von Wasser von außen verhindert. Darüber hinaus muss aber auch verhindert werden, dass Wasserdampf von innen oder Bodenfeuchte in das Bauteil eindringen.
